L'hemoglobina (Hb) és una metal·loproteïna que conté ferro i que es troba abundantment als glòbuls vermells de pràcticament tots els vertebrats. Sovint se l'anomena la "molècula que sustenta la vida" pel seu paper indispensable en la respiració. Aquesta complexa proteïna és responsable de la tasca crítica de transportar oxigen des dels pulmons a tots els teixits del cos i facilitar el retorn del diòxid de carboni per a l'excreció. Comprendre la seva funció, els elegants mecanismes que governen el seu comportament i la importància cabdal de la seva mesura clínica ofereix una finestra a la salut i les malalties humanes.
Funció i mecanisme: una obra mestra de l'enginyeria molecular
La funció principal de l'hemoglobina és el transport de gasos. Tanmateix, no realitza aquesta tasca com una simple esponja passiva. La seva eficiència prové d'un disseny estructural sofisticat i d'uns mecanismes reguladors dinàmics.
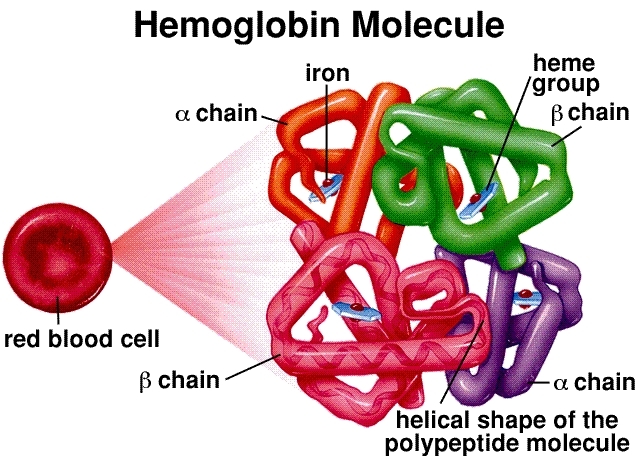
Estructura molecular: L'hemoglobina és un tetràmer, compost per quatre cadenes de proteïnes de globina (dues alfa i dues beta en adults). Cada cadena està associada a un grup hemo, una estructura circular complexa amb un àtom de ferro central (Fe²⁺). Aquest àtom de ferro és el lloc d'unió real per a una molècula d'oxigen (O₂). Per tant, una sola molècula d'hemoglobina pot contenir un màxim de quatre molècules d'oxigen.
Unió cooperativa i la corba sigmoïdal: Aquesta és la pedra angular de l'eficiència de l'hemoglobina. Quan la primera molècula d'oxigen s'uneix a un grup hemo als pulmons (on la concentració d'oxigen és alta), indueix un canvi conformacional en tota l'estructura de l'hemoglobina. Aquest canvi facilita que les dues molècules d'oxigen següents s'uneixin. La quarta molècula d'oxigen final s'uneix amb la major facilitat. Aquesta interacció "cooperativa" dóna lloc a la corba de dissociació d'oxigen sigmoïdal (en forma de S) característica. Aquesta forma de S és crucial: significa que en l'entorn ric en oxigen dels pulmons, l'hemoglobina es satura ràpidament, però en els teixits pobres en oxigen, pot alliberar una gran quantitat d'oxigen amb només una petita caiguda de pressió.
Regulació al·lostèrica: l'afinitat de l'hemoglobina per l'oxigen no és fixa; s'ajusta amb precisió a les necessitats metabòliques dels teixits. Això s'aconsegueix mitjançant efectors al·lostèrics:
L'efecte Bohr: En els teixits actius, una alta activitat metabòlica produeix diòxid de carboni (CO₂) i àcid (ions H⁺). L'hemoglobina detecta aquest entorn químic i respon disminuint la seva afinitat per l'oxigen, cosa que provoca una alliberació més generosa d'O₂ exactament on més es necessita.
2,3-Bisfosfoglicerat (2,3-BPG): Aquest compost, produït als glòbuls vermells, s'uneix a l'hemoglobina i n'estabilitza l'estat desoxigenat, cosa que promou encara més l'alliberament d'oxigen. Els nivells de 2,3-BPG augmenten en condicions d'hipòxia crònica, com ara a grans altituds, per millorar l'aportació d'oxigen.
Transport de diòxid de carboni: L'hemoglobina també juga un paper vital en el transport de CO₂. Una petita però significativa porció de CO₂ s'uneix directament a les cadenes de globina, formant carbaminohemoglobina. A més, en tamponar els ions H⁺, l'hemoglobina facilita el transport de la major part del CO₂ com a bicarbonat (HCO₃⁻) al plasma.
La importància crítica de les proves d'hemoglobina
Donat el paper central de l'hemoglobina, mesurar-ne la concentració i avaluar-ne la qualitat és un pilar fonamental de la medicina moderna. Una prova d'hemoglobina, que sovint forma part d'un hemograma complet (CBC), és una de les investigacions clíniques més sol·licitades. La seva importància no es pot exagerar pels motius següents:
Monitorització de la progressió i el tractament de la malaltia:
Per als pacients diagnosticats amb anèmia, les mesures seriades d'hemoglobina són essencials per controlar l'eficàcia del tractament, com ara la suplementació amb ferro, i per fer un seguiment de la progressió de malalties cròniques subjacents com la insuficiència renal o el càncer.
Detecció d'hemoglobinopaties:
Les proves d'hemoglobina especialitzades, com l'electroforesi de l'hemoglobina, s'utilitzen per diagnosticar trastorns genètics hereditaris que afecten l'estructura o la producció de l'hemoglobina. Els exemples més comuns són l'anèmia falciforme (causada per una variant defectuosa de l'HbS) i la talassèmia. La detecció precoç és vital per al maneig i l'assessorament genètic.
Avaluació de la policitèmia:
Un nivell d'hemoglobina anormalment alt pot indicar policitèmia, una afecció en què el cos produeix massa glòbuls vermells. Això pot ser un trastorn primari de la medul·la òssia o una resposta secundària a la hipòxia crònica (per exemple, en malalties pulmonars o a grans altituds), i comporta un risc de trombosi.
Cribratge i avaluació general de la salut: Les proves d'hemoglobina formen part de l'atenció prenatal, les revisions prequirúrgiques i els exàmens generals de benestar. Serveix com a indicador general de la salut i l'estat nutricional.
Control de la diabetis: Tot i que no és l'hemoglobina estàndard, la prova d'hemoglobina glicada (HbA1c) mesura quanta glucosa s'ha unit a l'hemoglobina. Reflecteix els nivells mitjans de sucre en sang durant els darrers 2-3 mesos i és el criteri de referència per al control glucèmic a llarg termini en pacients diabètics.
Conclusió
L'hemoglobina és molt més que un simple transportador d'oxigen. És una màquina molecular de disseny exquisit, que utilitza la unió cooperativa i la regulació al·lostèrica per optimitzar el subministrament d'oxigen en resposta a les necessitats dinàmiques del cos. En conseqüència, la mesura clínica de l'hemoglobina no és només un número en un informe de laboratori; és una eina de diagnòstic i monitorització potent i no invasiva. Proporciona una instantània indispensable de la salut hematològica i general d'una persona, permetent el diagnòstic d'afeccions que alteren la vida, el monitoratge de malalties cròniques i la preservació de la salut pública. Comprendre tant el seu geni biològic com la seva importància clínica subratlla per què aquesta humil proteïna continua sent una pedra angular de la ciència fisiològica i mèdica.
Data de publicació: 17 d'octubre de 2025